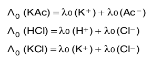This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കോള്റൗഷ് നിയമം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
കോള്റൗഷ് നിയമം
Kohlrausch's Law
ഭൗതികശാസ്ത്രത്തില് ഒരു ഇലക്ട്രൊളൈറ്റിന്റെ തുല്യാങ്കചാലകതയെ (Λ) സംബന്ധിക്കുന്ന നിയമം.
ഇതില് C വിലയനത്തിന്റെ സാന്ദ്രതയെ കുറിക്കുന്നു. C തുല്യാങ്കം വിലേയപദാര്ഥം ഒരു ലിറ്റര് വിലയനം ഉള്ക്കൊള്ളുന്നെങ്കില് അതിന്റെ സാന്ദ്രത C ആയിരിക്കും. വിലയനത്തിന്റെ വിശിഷ്ട ചാലകത (K) നിര്വചിക്കപ്പെടുന്ന സമീകരണമാണ് K = l/aR. ഇവിടെ ഞ ഏകസമാനമായതും I മീറ്റര് നീളമുള്ളതും a വര്ഗമീറ്റര് അഥവാ ചതുരശ്രമീറ്റര് പരിക്ഷേത്രമുള്ളതുമായ ഒരു കോളം വിലയനത്തിന്റെ ഓം-ലുള്ള പ്രതിരോധമാണ്.
1860-നും 80-നും ഇടയ്ക്കായി എഫ്.ഡബ്ല്യൂ. കോള്റൗഷും സഹപ്രവര്ത്തകരും അനവധി ഇലക്ട്രൊളൈറ്റുകളുടെ തുല്യാങ്കചാലകതകള് നിര്ണയിക്കുകയുണ്ടായി. ഇവയുടെ അടിസ്ഥാനത്തില് താഴെ കൊടുക്കുന്ന രണ്ട് എംപിരിക നിയമങ്ങള് കണ്ടുപിടിക്കപ്പെട്ടു. ഇവിടെ ആദ്യമായി കൊടുത്തിരിക്കുന്ന നിയമമാണ് കോള്റൗഷ് നിയമം എന്നു പ്രസിദ്ധി നേടിയിട്ടുള്ളത്.
കോള്റൗഷ് നിയമം. ഇലക്ട്രൊളൈറ്റിലെ വിവിധതരം അയോണുകളുടെ സ്വതന്ത്രമായ അഭിഗമനത്തെപ്പറ്റിയുള്ള നിയമം (1876).
ഒരു ഇലക്ട്രൊളൈറ്റിന്റെ അനന്തതനുതാവസ്ഥയിലെ തുല്യാങ്കചാലകതയ്ക്ക് അതിലെ ഓരോ അയോണും തനതും അതിനോടു ചേര്ന്നിരിക്കുന്ന മറ്റ് അയോണുകളുമായി ബന്ധപ്പെടാത്തതുമായ ഒരു ഓഹരി നല്കുന്നു.
പൂര്ണമായി അയോണീകരിക്കപ്പെട്ട ഇലക്ട്രൊളൈറ്റിന്റെ അവസ്ഥയാണ് 'അനന്തതനുതാവസ്ഥ'. ഈ നിയമമനുസരിച്ച് പൊട്ടാസ്യം ക്ലോറൈഡ് (KCL) വിലയനത്തിന്റെ അനന്തതനുതാവസ്ഥയിലെ തുല്യാങ്കചാലകത അതിലെ K+ അയോണുകളുടെയും Cl- അയോണുകളുടെയും തുല്യാങ്കചാലകതകള് ചേര്ന്നുണ്ടാവുന്നതാണ്.
ഈ നിയമത്തിന്റെ ഒരു പ്രധാന ഉപയോഗം താഴെ കുറിക്കുന്നു.
ഒരു പ്രബല ഇലക്ട്രൊളൈറ്റിന്റെ അനന്തതനുതാവസ്ഥയിലെ തുല്യാങ്കചാലകത (Λ0) ബാഹ്യഗണനം വഴി കണ്ടുപിടിക്കുന്നു. അതുപോലെ ഒരു ദുര്ബല ഇലക്ട്രൊളൈറ്റിന്റെ (ഉദാ. അസെറ്റിക് ആസിഡ്; HAc) അനന്തതനുതാവസ്ഥയിലെ തുല്യാങ്കചാലകത (Λ0) കണ്ടുപിടിക്കുക സാധ്യമല്ല. എന്നാല് കോള്റൗഷ് നിയമം ഇത് സാധ്യമാക്കുന്നു. ഉദാ. ഇലക്ട്രൊളൈറ്റിന്റെ അനന്തതനുതാവസ്ഥയില് അതിന്റെ അയോണുകളുടെ തുല്യാങ്കചാലകതയെ λ0 കൊണ്ടു കുറിക്കാം. അപ്പോള് കോള്റൗഷ് നിയമമനുസരിച്ച്
ഈ സമീകരണങ്ങള് തമ്മില് കൂട്ടിക്കുറയ്ക്കുമ്പോള്
എന്നു കിട്ടുന്നു. ഈ സമീകരണത്തിലെ വലുതുവശം കോള്റൗഷ് നിയമമനുസരിച്ച് ആകുന്നു. അപ്പോള്
അതായത് അസെറ്റിക് ആസിഡിന്റെ അനന്തതനുതാവസ്ഥയിലെ തുല്യാങ്ക ചാലകത പൊട്ടാസ്യം അസറ്റേറ്റ്, ഹൈഡ്രോക്ലോറിക് ആസിഡ്, പൊട്ടാസ്യം ക്ലോറൈഡ് എന്നീ പ്രബല ഇലക്ട്രോളൈറ്റുകളുടെ അനന്തതനുതാവസ്ഥയിലെ തുല്യാങ്ക ചാലകതകളില് നിന്നു കണ്ടുപിടിക്കാന് കഴിയുന്നു.
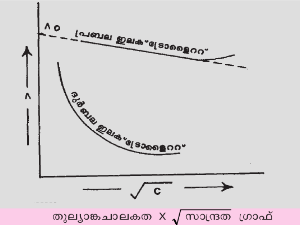
i. വര്ഗമൂല നിയമം (1885). ഒരു നിശ്ചിത താപനിലയില് ഒരു പ്രബല ഇലക്ട്രോളൈറ്റിന്റെ അതിയായി നേര്ത്ത വിലയനത്തിന്റെ തുല്യാങ്ക ചാലകതയെ അതിന്റെ സാന്ദ്രതയുടെ വര്ഗമൂല്യവുമായി ബന്ധിപ്പിച്ചു വരയ്ക്കുന്ന ഗ്രാഫ് ഒരു നേര്വരയായിരിക്കും. ഈ നേര്വര പിന്നോട്ടു ദീര്ഘിപ്പിച്ച് ഇലക്ട്രോളൈറ്റിന്റെ അനന്തതനുതാവസ്ഥയിലെ തുല്യാങ്ക ചാലകത (Λ0) ബാഹ്യഗണനം വഴി കണ്ടുപിടിക്കാം. വര്ഗമൂലനിയമത്തെ Λ α √c എന്നു സംഗ്രഹിച്ചെഴുതാം. നാല്പതു വര്ഷത്തിനുശേഷം ഈ എംപിരിക നിയമത്തിനു ഡീബൈയ് (Debye), ഹ്യുക്കല് (Huckel), ഓണ്സാഗര് (Onsager) എന്നിവര് സിദ്ധാന്തപരമായ അടിസ്ഥാനം കൊടുക്കുകയുണ്ടായി.
(പ്രൊഫ. ടി.ബി. തോമസ്)